发表论文
美国科学院院刊发表我室酶结构研究创新成果
作者: 发布时间:2014-10-24 14:10:00
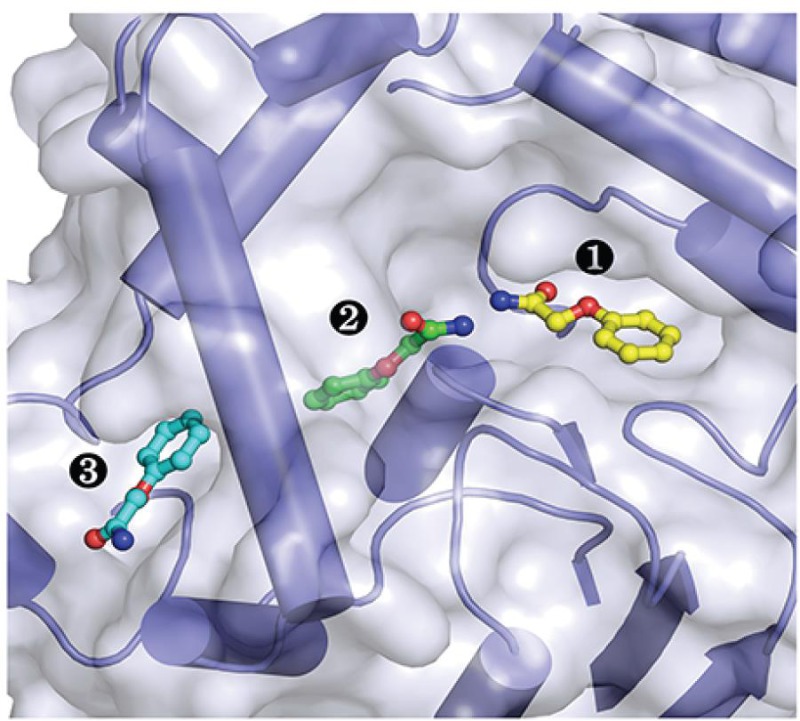
图片说明:底物类似物与环氧水解酶结合位置示意图
①底物进入通道;②催化反应部位;③产物释放通道
环氧水解酶催化环氧化物的立体选择性水解,所得光学纯环氧化合物或邻位二醇可用于制备b-阻断剂等手性药物。天然来源的环氧水解酶在药物合成中没有广谱性,特别是对一些大位阻的底物只有很低的催化活性和立体选择性。传统的蛋白质工程改造研究基本都集中在底物进入通道以及酶催化活性中心区域上。在本研究中,研究人员首先解析了巨大芽孢杆菌环氧水解酶BmEH及其与底物类似物复合物的高分辨率晶体结构,然后,从结构信息和酶动力学数据出发推测该环氧水解酶存在独立的产物释放通道,这与现已报道的环氧水解酶结构存在显著差别。该假说得到了蛋白质质谱、突变体三维结构、分子动力学模拟等实验结果的证实,揭示了酶的活性中心与产物释放通道之间的区域是影响催化活性的瓶颈位置。对这些新发现的关键位点进行定点突变,大幅度提高了酶对大位阻底物的催化活性和立体选择性,其中对心血管药物分子普洛奈尔手性前体的拆分效率提高了100倍。在此基础上,对这些位点进行饱和突变可以量身定制出不对称合成其他β-阻断剂药物前体的环氧水解酶突变体库(Angew Chem Int Ed 2014, 53: 6641–6644),该工作被SynFact (2014, 10(8): 0886)作为亮点报道。
该项研究首次发现了环氧水解酶催化过程中产物释放的效率直接影响不同底物整体反应的快慢,创新性地提出了针对产物释放限制部位进行酶分子改造的新策略。研究成果凸显了酶的构效关系研究和理性设计方法在蛋白质工程和生物催化技术中的巨大应用潜力。该研究得到国家重点基础研究发展计划和国家自然科学基金的大力支持。
原文检索:Xu-Dong Kong, Shuguang Yuan, Lin Li, She Chen, Jian-He Xu, Jiahai Zhou. Engineering of an epoxide hydrolase for efficient bioresolution of bulky pharmaco substrates. PNAS, October 20, 2014, doi:10.1073/pnas.1404915111。
